- ボルタ電池が出来るまでの歴史
- 亜鉛&銅の”ボルタ電池”の作り方
- 電子の移動とイオンへの変化
- 進化した”ダニエル電池”について
-300x300.png)
世界初の電池を学んでいこう!
-300x300.png)
この授業はYoutubeで解説してます!
動画が見られる方はこっちのが動画もあってわかりやすいです!
ボルタ電池の歴史
ボルタ電池が作られたのは1800年のイタリアです。

200年前から電池があるんだ!
はい、200年前から電池があるといっても当時の電池は今の電池と全然違って、当時の電池はむちゃくちゃしょぼいやつでした。そんな世界初の電池について学んでいきましょう!
- ルイージ・ガルバーニ → 動物電池を発見した
- アレッサンドロ・ボルタ → 化学電池を世界で初めて作った
ガルバーニの電池
最初に電池っぽいを見つけたのはこのガルバーニです。
ガルバーニはお医者さんで、カエルを使った実験をしている時に死んでるはずのカエルの足が動くのを発見しました。
これが初めて見つかった電池”ガルバーニの電池”です!



最初の電池はたまたま発見されたんだ
ガルバーニの電池は、カエルの解剖している時に二種類の違う金属のメスがカエルの脚に触れた瞬間にピクっと脚が動いたことから発見されました。
.jpg)
.jpg)


ガルバーニはピクっと動いた原因はカエルの神経にあるとして神経電池の研究を進めました。
ただ実際は後にボルタが発見したように、カエルの脚が原因ではなく金属のほうが原因だったのでこの研究は無駄になってしまいました、、、



ガルバーニが世界初になる可能性もあったのに
ボルタの電堆
ガルバーニの発見後、1791年からボルタという科学者はこの動物電池について研究を進めていく中で、こう思いました。
「神経じゃなくて電池が関係してんじゃね!」と



ボルタは金属に注目したんだね
そう、その結果ボルタはしょぼい電池をつくることができたんです!


そしてボルタは動物の体ではなく、食塩水を使って電気を作ることに成功しました!こうしてできた電池を「ボルタの電堆」といいます。
ボルタの電堆の作りは超超超シンプルで、2種類の金属(亜鉛・銅)の間に食塩水を示させて紙を差し込んで、ハンバーガーみたいなやつをたくさん作って、重ね合わせたものです!
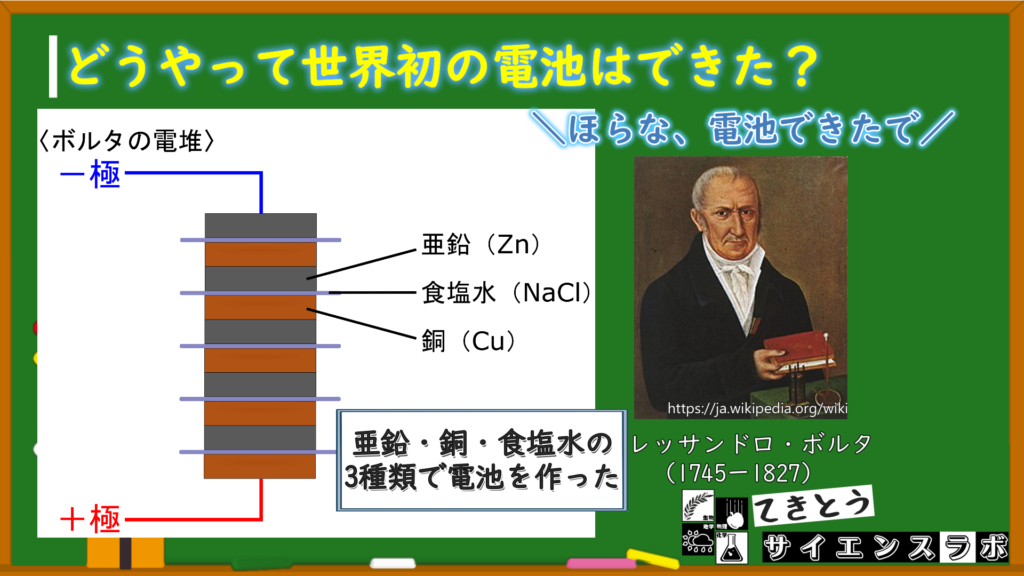




めちゃくちゃシンプル!
そう!このシンプルなつくりの電池こそ、今の電池の元になっている世界で最初の電池なんです!
世界で初めての電池「ボルタの電堆」は亜鉛・銅・食塩水から作られた!
それじゃ次に実際に実験をしてボルタの電堆を作ってみましょう!
ボルタの電池を作ろう!
さっそく実験していきましょう!



実験だ~~
材料はめちゃくちゃ少ないよ!
- 金属板(亜鉛・銅)
- 水溶液(塩酸or硫酸or食塩水など)
- それっぽい容器



これなら家でも作れそう!
はい、簡単に家でもつくることができます!家で簡単に作る方法は最後に軽~く説明しておきます。
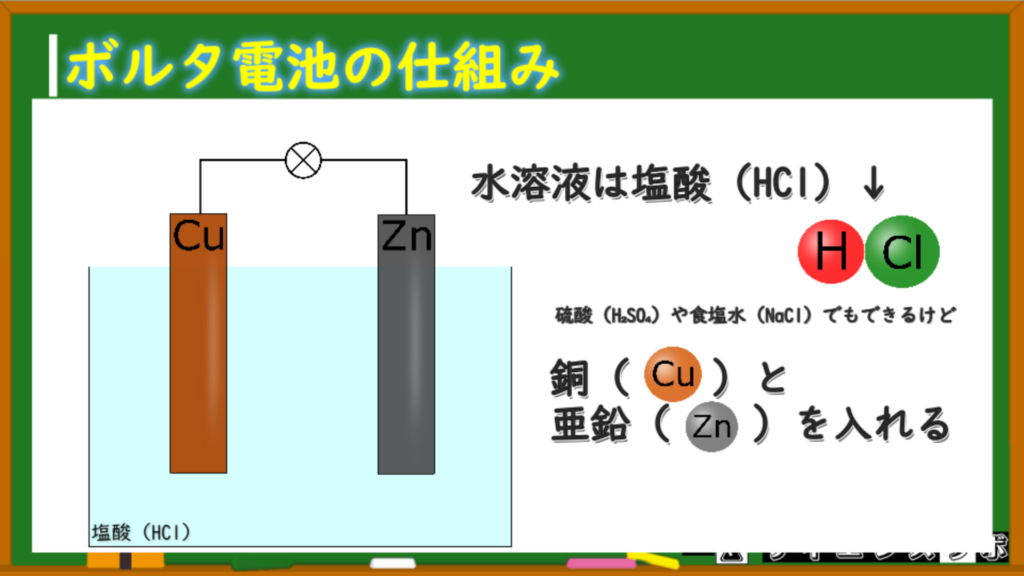
今回は塩酸・亜鉛板・銅板の3つを使って実験します。
作り方ってほど難しいことはなくて、塩酸に亜鉛板&銅板を突っ込むだけで、ボルタ電池の完成です!





なんて簡単なんだ!!!
これが電池だなんて信じにくいですね。でも2つの金属板を塩酸の中に入れて、モーターにつなぐだけでモーターが回り始めました!要するに電流が流れてるってことです。
塩酸の中に亜鉛板と銅板を入れて二つをつなげば電池になる!
塩酸の中に亜鉛板と銅板を入れると亜鉛板の方から気体が発生しました!
でも実は銅板の方からも気体が発生しています!(よく見えないけど!)この時発生している気体は”水素”で電流を作るのにとても大切になんです!


次に金属板を取り出して様子を観察してみましょう!



亜鉛板は黒くなった!
銅板の方はピカピカだけど、亜鉛板は新品を使っているはずなのに色が変わってしまいました!


亜鉛板がボロボロになった理由は”亜鉛板の一部が溶けてなくなった”からです!



溶けちゃったの?
そういうことです!金属電池は片方の金属原子がイオンになることによって電流を生み出しています。詳しい仕組みについて電子に注目して考えていきましょう!
ボルタ電池は亜鉛がイオンになることによって電流を生み出している!
ボルタ電池の仕組み
-300x300.png)
-300x300.png)
ボルタ電池の仕組みを理解しよう!
今回の学習の一番大切なポイントはここです!しっかりと理解して行きましょう!
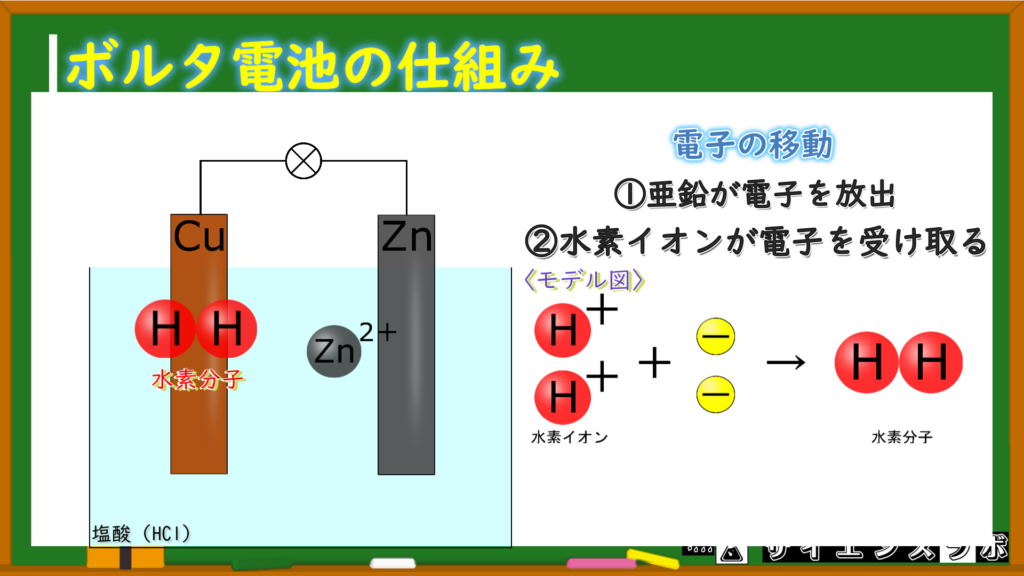
ボルタ電池に関係する原子・分子
最初にボルタ電池がどんな原子・分子で出来ているのか考えます。
水溶液は塩酸(HCl)で、その中に亜鉛(Zn)と銅(Cu)が入っています。
電流が流れるってことは、これらの原子・分子たちが変化しているってことです!
さて、どんな変化をしているのか考えていきましょう!

イオン化傾向と電子の移動
さて、電流が流れるとはどういうことでしょうか?



電子が動くってこと?
その通り!電流が流れる=電子が移動するってことです!
イメージで言うと野球のピッチャーとキャッチャーの両方が必要って感じ
電子の移動は原子レベルで見ると電子を出す側と電子を受け取る側の二つの原子が必要です。
今回の場合、亜鉛(Zn)と銅(Cu)のイオン化傾向を比べると亜鉛の方がイオン化傾向が大きい(イオンになって電子を放出する)から亜鉛(Zn)がイオンになります。



亜鉛がピッチャー!
つまり、亜鉛板から電子が流れてきて、銅板にやってきます。
この時モーターなり豆電球なりを通るからモーターが回ったり豆電球が光ったりします。
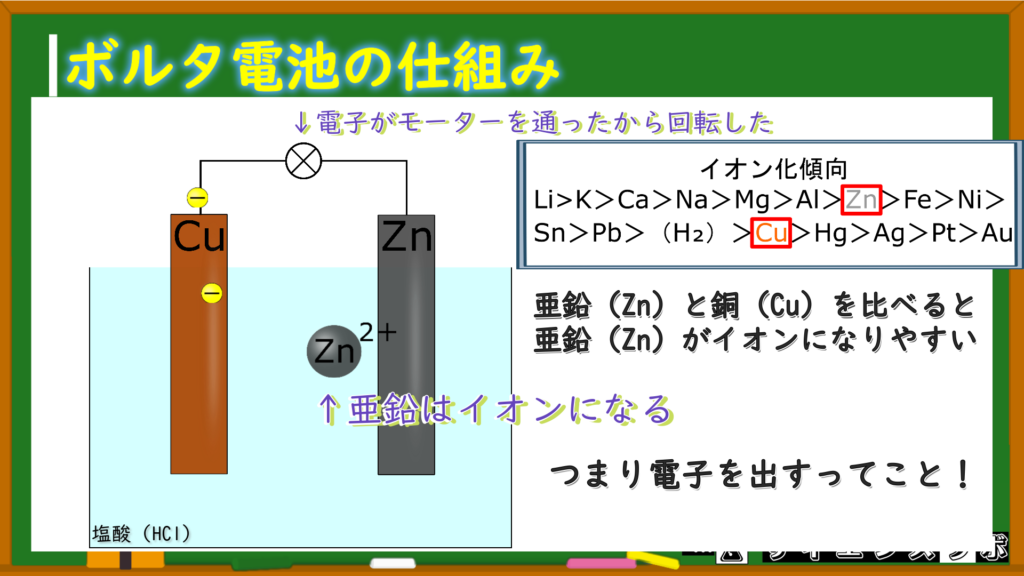

亜鉛がイオンになることで電子を放出して電流を作っている
この時の亜鉛の変化はこんな反応です。





亜鉛が電子を出しているのがわかりやすい!
今回の学習はイオン化傾向が超大事だから、「イオン化傾向なんて知らんわっ」って人は先にイオン化傾向を勉強すると理解が深まります!
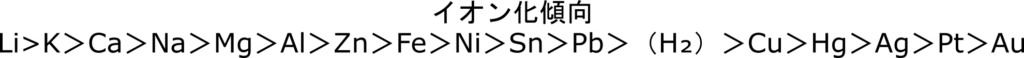
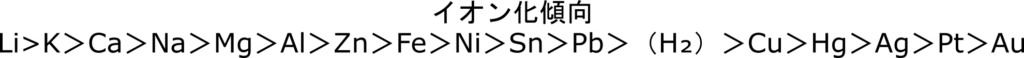
イオン化傾向については↓
(執筆中)
電子を受け取る原子
電子を放出するのが亜鉛(Zn)とわかったから、電子を受け取る原子の方も考えてみましょう!



銅じゃないの?
亜鉛板から電子が出ているから反対側にいる銅が電子を受け取っている気がするけど、実はそうじゃないんです!
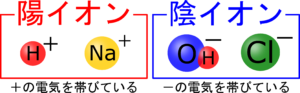
電子は-の電気を帯びているから、電子を受け取る方は+の電気を帯びている必要があります。で、銅は今原子(+でも-でもない)の状態で、銅がイオンになる時はCu⁺の陽イオンになるから+の電気が欲しいはずです。
(マイナスの電気を持つ電子をもらうってことは、原子にマイナスの電気が入ってイオンになるということ)



ってことは銅が電子を受け取っていないわけだ
電子を受け取るのは”銅”じゃない!



それならだれが受け取っているの?
電子を受け取るためには、マイナスの電気をもらうわけだからもらう前はプラスの電気を帯びている必要があります。
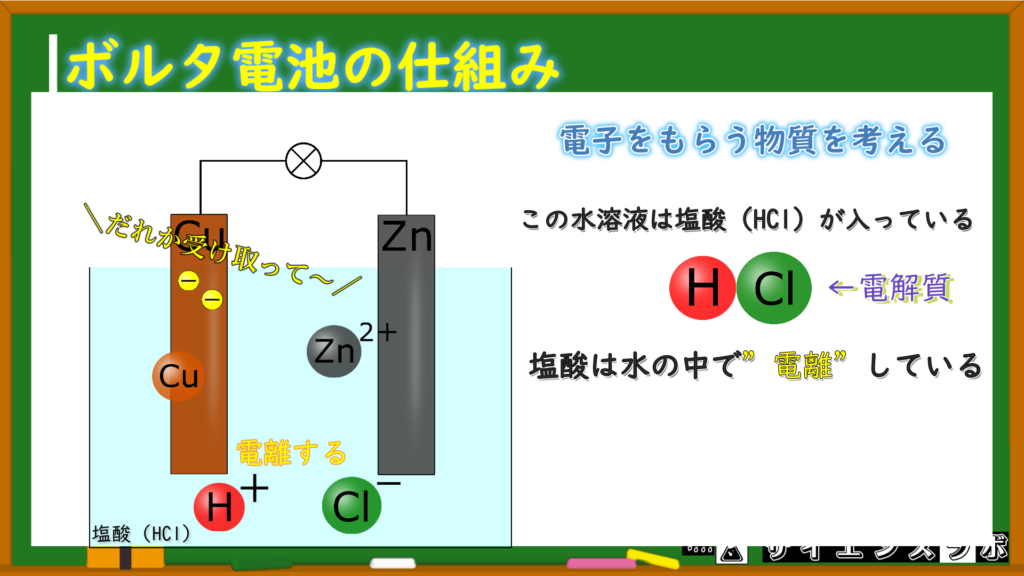
ボルタ電池の中にある粒子を考えてみると、この粒たちが水溶液の中にいます。
亜鉛イオン(Zn⁺)・・・イオン化傾向が大きい亜鉛原子が電子を放出してできた
水素イオン(H⁺)・・・塩酸が電離してできた
塩化物イオン(Cl⁻)・・・塩酸が電離してできた
(水が電離して水酸化物イオンもいるっちゃいるけど、今回は割愛)



そっか塩酸が電離するとイオンになるんだったね
そうです!
亜鉛や銅以外にも水溶液中にイオンが存在しています!
電離については↓で勉強してね♪
(頑張って執筆中)

-300x300.png)
-300x300.png)
じゃあ電子を受け取っているのはどれかな?



プラスの電気を持ってるH⁺!
-300x300.png)
-300x300.png)
大正解!
水素イオン(H⁺)は-の電気を欲しがっているから電子を受け取って分子になります!
イオン化傾向の大きい亜鉛が電子を放出する(ピッチャー)
水溶液中にある電子が欲しい(プラスの電気を持っている)水素イオンが電子を受け取る(キャッチャー)
このようにしてボルタ電池には電流が流れています。
-300x300.png)
-300x300.png)
次にボルタ電池のメカニズムを考えて行こう!
ボルタ電池の仕組み
仕組みを簡単に説明すると↓のようになります。




それぞれのstepについて解説していきます!
亜鉛が電子を放出
まず最初にイオン化傾向が大きくて陽イオンになりやすい(電子を放出しやすい)亜鉛原子が電子を放出を放出します。





2つの電子を出すんだね
そうですね。亜鉛イオンは2価の陽イオンだから電子を2つ出してイオンになります。
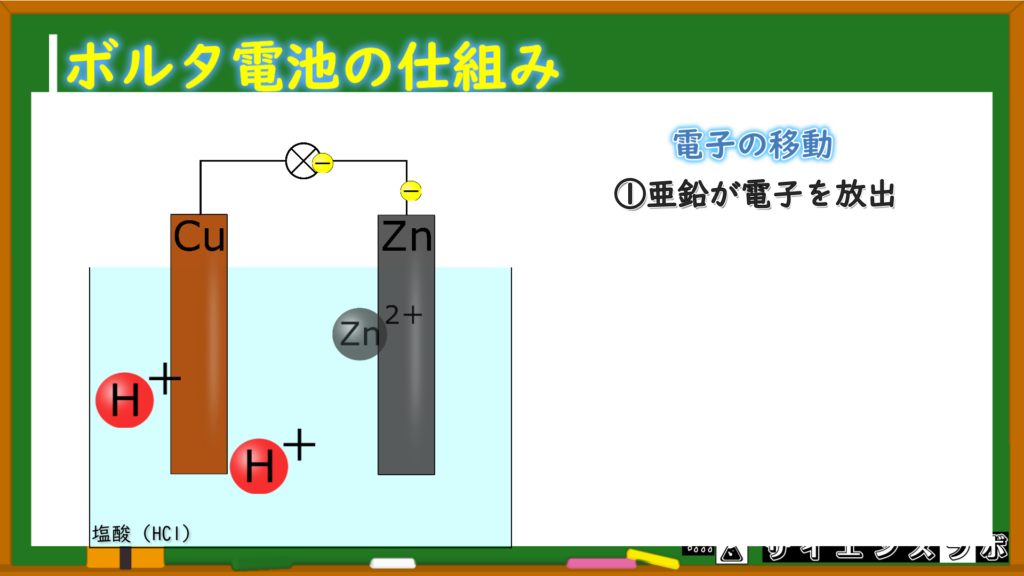

+極側では亜鉛が亜鉛イオンになって電子を放出する
水素イオンが電子を受け取る
亜鉛が放出した電子を銅板側で水素イオンが待ち構えて電子をゲットします。
この時の電子の動きはこんな感じです。





水素イオン1つは電子1つを受け取るんだね
そうです!水素イオンは1価の陽イオンだから、1つのイオンあたり1つの電子を受け取ることになります。
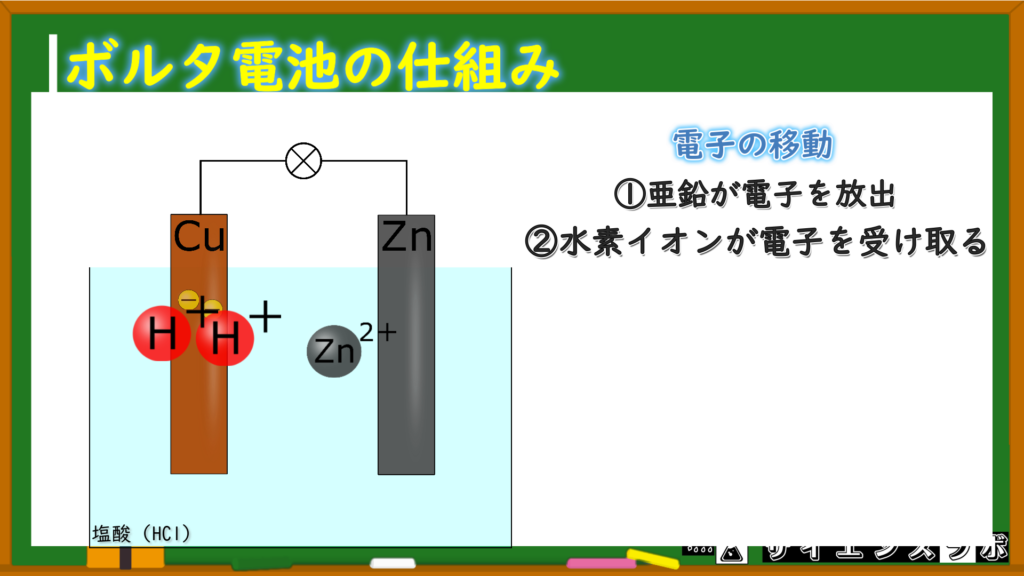

-極側では、水素イオンが電子を受け取って水素分子になる
水素イオンが水素分子となって空気中に出ていく
そうして出来た水素分子は気体だから、銅板の方から気体となって発生します。

まとめ
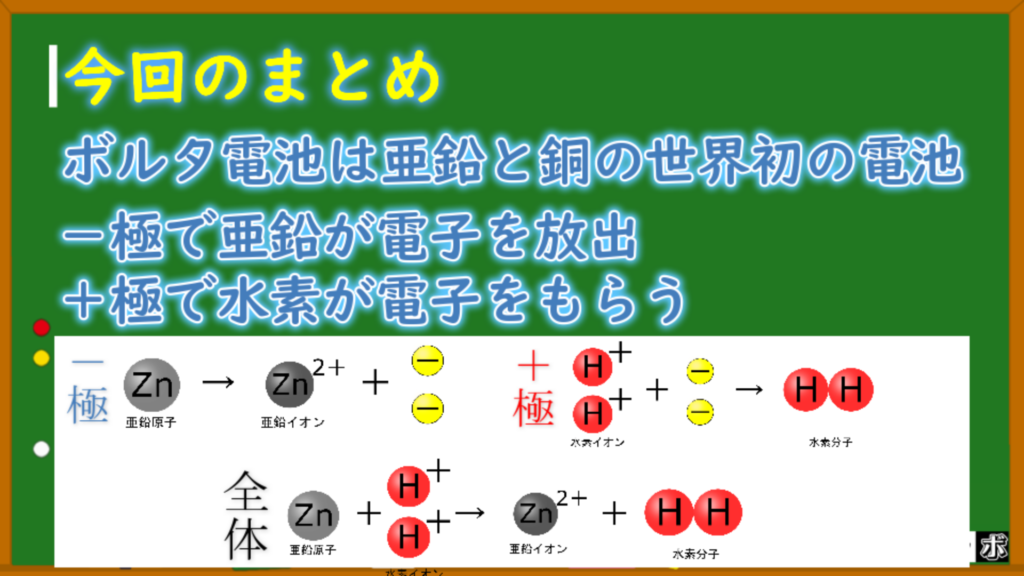
ってことで、ボルタ電池全体で電子の動きをまとめるとこう!


亜鉛原子がイオンになって電子を放出する
Zn → Zn²⁺ + 2e⁻


水素イオンが電子を受け取って水素分子になる
2H⁺ + 2e⁻ → H₂


全体では亜鉛原子と水素イオンが反応して亜鉛イオンと水素分子になる
Zn + 2H⁺ → Zn²⁺ + H₂
-300x300.png)
-300x300.png)
電子の移動を理解できればボルタ電池も完璧♪
ボルタ電池の弱点
世界初のボルタ電池はさんざん雑魚と言っているように、圧倒的な弱点があります。



単位に残るくらいスゴイ発明なのに?
はい、その弱点とは「分極」という電池としての機能がスグに失われてしまうという弱点です!



そんなの全然だめじゃん!
はい、だからぶっちゃけボルタ電池ってのはしょぼい電池なんです。
一般的に説明されている理由としては、銅板で発生する水素がめっちゃくちゃ多くて、銅板の周りにいるから水素分子がじゃまで電子が欲しい水素イオンの邪魔をしてしまうとされています。
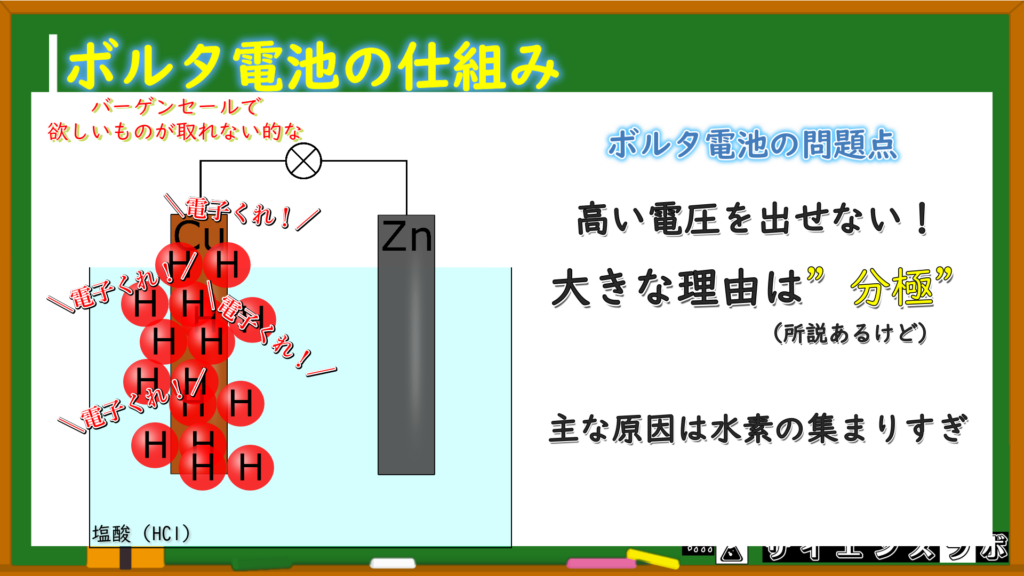

この銅板に溜まった水素分子を逃すために分極剤と呼ばれる物質(たいていは過酸化水素H₂O₂)を入れることで解消します。
ボルタ電池にはすぐに電圧が弱くなるという弱点がある
進化した電池



でも今の電池はスグに使えなくならなくない?
その通り!ボルタ電池はたった3種類の物質から電池を作り上げた画期的な発明なんだけど、そんな弱点があったんだ。
すぐに起電力が低くなるっていう弱点を克服したのが、次の時代のダニエルが発明した”ダニエル電池”ってやつです!







仕切りがある!
この仕切りによってボルタ電池は0.7Vほどしか出せず、すぐその電圧すら弱くなっちゃったのに、ダニエル電池は1.1Vもの電圧を出すことが可能になったんです!
さらには、人類は”乾電池”という乾いた電池を作って、私たちの生活はめちゃくちゃ豊かになりました!



乾電池は乾いたって意味なんだ!
そうです!


ボルタ電池などは水溶液を使って電流を取り出していますが、乾電池は超少ない水溶液で電流をつくることを可能にしているんです!
次の学習ではボルタ電池から進化したダニエル電池について学んでいきましょう!
オマケ
ボルタ電池の作り方
-300x300.png)
-300x300.png)
最後に家でも出来るボルタ電池の作り方を乗せておきます!
- てきとうな容器
- 2種類の金属
- 導線&モーター
- 食塩水
これだけで簡単につくることができます♪
材料
お家でも簡単に手に入る材料で実験してみましょう!
容器
なんでもいいです。安くて使い捨てできる紙コップとかおすすめ。
金属板
ホームセンターで買ってもいいですが、表面の加工をやすりで磨かないと使えないから実験用のものを買うのが楽チンです♪
導線&モーター
モーターはしっかりと選ばないと実験大失敗していしまいます!ボルタ電池だと0.7Vほどしか電圧を出すことができないから、低電圧で回るモーターにしましょう!太陽光用のモーターがオススメです。
食塩水
お家にある塩を水道水に溶かせばOK!岩塩でもクレイジーソルトでもなんでも
まとめ

.jpg)
.jpeg)





 サムネ-300x164.jpg)



コメント