酸性×アルカリ性=?
酸性の液体とアルカリ性の液体を混ぜると何性?

めっちゃ強い液体!
ほう、なんで?

どっちも強いから合わさったらめっちゃ強い!
確かに、塩酸は強い酸性を示す液体で金属を溶かす力を持ってましたね。
水酸化ナトリウムも強いアルカリ性を示し、これも金属を溶かすことができます。
じゃあ、実際に塩酸と水酸化ナトリウムを混ぜて金属を入れてみましょう!
(画像準備中)

あれ?溶けなくなった???
そうなんです!酸性とアルカリ性を混ぜると「両方の性質を打ち消してしまう」んです!!
実際にBTB液を使って、酸性とアルカリ性の液体を混ぜて色を調べてみましょう!

緑色ってことは中性?
そうなんです!中性になっているから金属を溶かすことができなかったんですね。
前回の学習で、酸性やアルカリ性の液体の中には金属を溶かすものがありましたが、中性で溶かすものはありませんでしたね。
このように酸性の液体とアルカリ性の液体を混ぜて、お互いの性質を打ち消すことを“中和”といいます。
緑色になったら中和ってことかな?
いいえ違います!!
中和はお互いの性質を打ち消すことを意味してるから、100mLの塩酸に水酸化ナトリウムを1滴入れただけでも、1滴分の中和は起こっているから中和したって言うことができます。
入れた後の水溶液の性質は関係なくて、少しでも打ち消し合ったら中和ってことです!
酸性とアルカリ性が少しでも打ち消し合ったら中和
中性になることではない!!

でもなんで中性になったの?
不思議だね。イオンに注目して、中和を理解していきましょう!
中和したときのイオン
酸性とアルカリ性の正体ってなんだっけ?

リトマス紙で調べた気がする!
大正解!酸性・アルカリ性の正体はリトマス紙の上に水溶液をたらして電圧をかける実験で解明することができましたね。
酸性の正体がH⁺でアルカリ性の正体がOH⁻だったね!
電離の式の例を挙げると

こんな感じだね。
酸性のH⁺とアルカリ性のOH⁻が混ざったら何ができそう?

え?なんだろ?
原子の数にに注目するとHが2個とOが1個あるよね。

H₂Oができる?
はいそういうことです!酸性の示すH⁺とアルカリ性を示すOH⁻は混ざり合うと、なんと中性のH₂O(水)になるんだ!

酸性を示すH⁺とアルカリ性を示すOH⁻が反応して水ができる
酸性・アルカリ性の変化
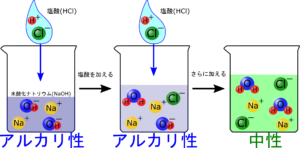
イラストを見ながら水酸化ナトリウム水溶液に塩酸を加えていった時の変化をみてみましょう!
最初のビーカーは水酸化ナトリウムだけが入っている状態だね。


OH⁻が入っているからアルカリ性なんだね!
最初の水酸化ナトリウムに塩酸を少し加えると中性になるね。この変化はこう
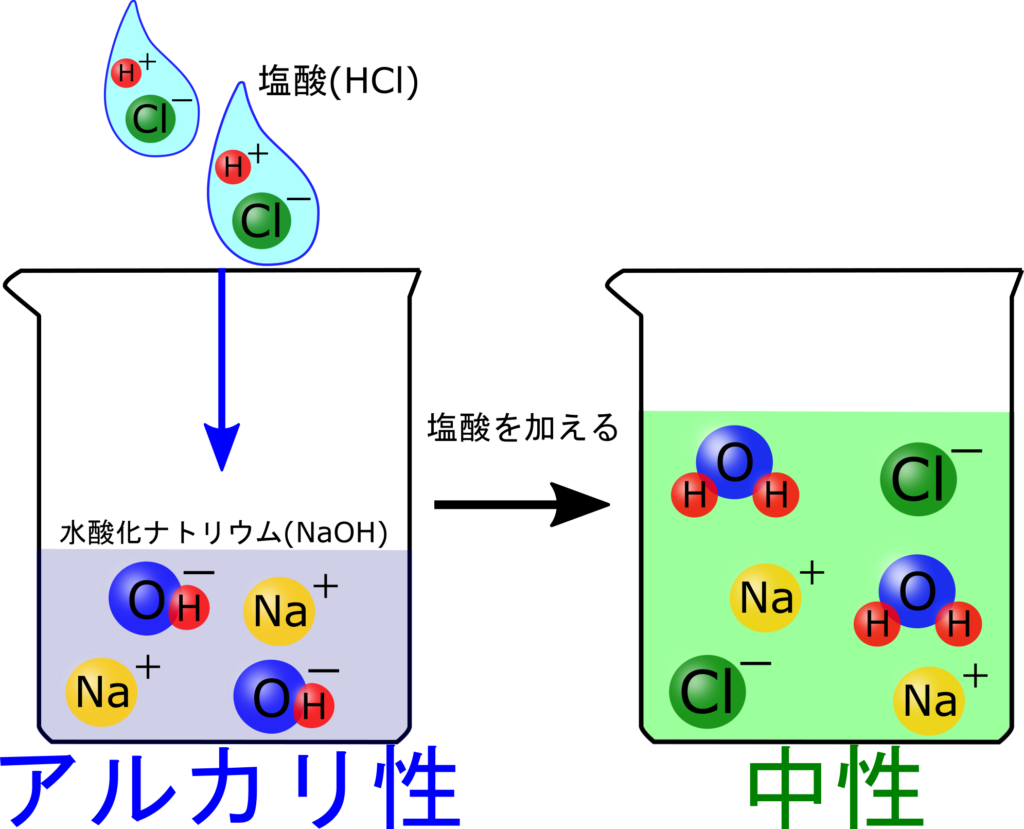

水溶液の中のOH⁻がなくなってる!
OH⁻は塩酸に含まれるH⁺と反応して
OH⁻+H⁺→H₂O
になっているってことですね。

だからH⁺を入れているのに水溶液中は増えてないんだね!
中和して中性になった水溶液の中にはOH⁻が入っていないから、加えたH⁺が反応せずに水溶液の中に残ってるんだ。

H⁺は中性になってから増えるんだね!
そういうことです!
水溶液の中のOH⁻が多い時はアルカリ性
OH⁻もH⁺もない時は中性
H⁺が多い時は酸性
中性になった時のイオンに注目してみましょう!
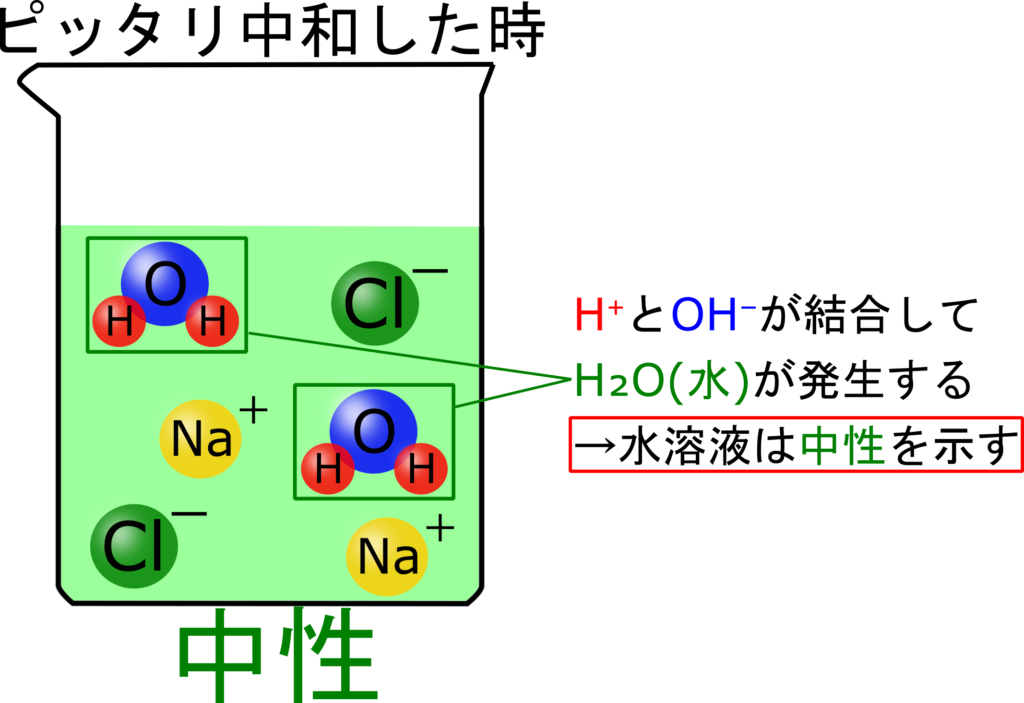

OH⁻もH⁺もなくなっているね
H₂O以外にもNa⁺やCl⁻も存在していますね。
これってどこかで見たことありませんか?

う~ん、なんだろ?
Na⁺とCl⁻ってNaClが電離したらできるってことを覚えてますか?


水溶液に電流が流れるかって実験でやったね!
そうです!固体の塩化ナトリウム(食塩)を水に溶かすと、今回の中和の実験でちょうど中性にしたものと同じになりますね。

じゃあ水酸化ナトリウムと塩酸を混ぜると食塩水ができるんだ!
そういうことです!
じゃあ実際に食塩ができているか調べてみましょう!
塩酸と水酸化ナトリウム水溶液を混ぜると食塩水になる!?
食塩ができたのか調べよう!
水溶液の中に溶けている物質が「食塩」なのかはどうやって調べればいいでしょうか?

冷やすのは?
再結晶って方法だね!
でも再結晶は、ミョウバンみたいな温度によって溶解度が大きく変わる物質じゃないとたくさんの結晶を取り出すことができません。
それ以外の方法はなんでしょうか?

水を蒸発させる!
大正解!
食塩みたいな温度が変わっても、溶解度の変化が小さい物質は水の量を減らす必要があるんですね!
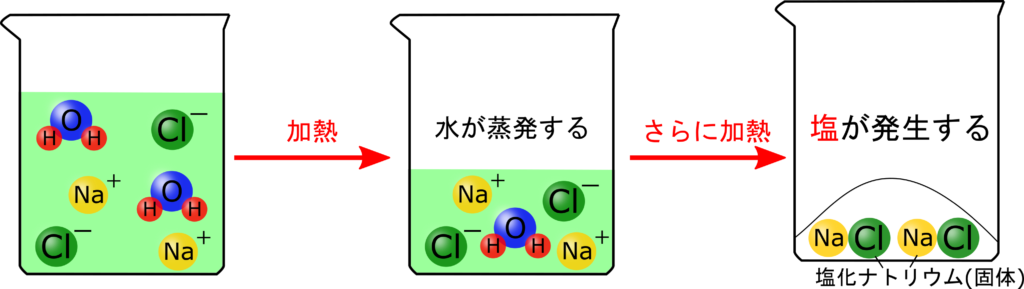
じゃあ実際に中和して中性になった水溶液を蒸発皿にとって加熱してみましょう!


白くなってる!
これが食塩です!
酸性の液体とアルカリ性の液体を混ぜると必ず「水」と「塩(えん)」が発生します。

塩(えん)?
塩(しお)とは違って“えん“って読みます。塩(えん)は中和の時に発生しますが、塩化ナトリウム以外にも、水酸化バリウムと硫酸を混ぜると硫酸バリウムができたりと、塩にもいろいろな種類があります。
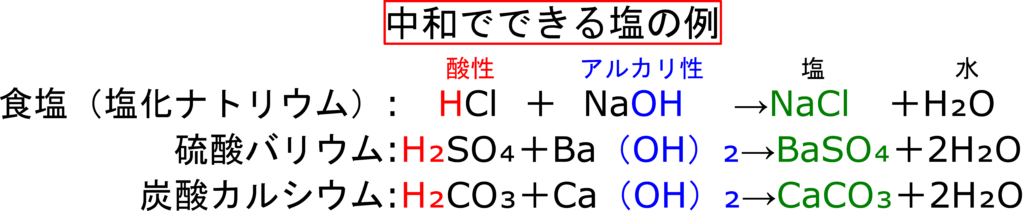
なかでも塩化ナトリウムは「食べられる塩」だったから、“食塩“と呼ばれているんです!

塩にはいくつか種類があるんだね!
中和すると「水」と「塩(えん)」が発生する
ちなみに、この反応をイラストで表すとこんな感じになります!
中和の化学反応
塩ができる化学反応をいくつかみてみましょう!

どれも水と塩ができるね!
ルールがわかると反応式が書きやすいね!
今まで実験で使ってきた石灰水もなんと中和反応なんです!
水酸化カルシウム(石灰水)の水溶液はアルカリ性を示し、二酸化炭素は酸性を示しますね。
これを反応式で書くとこうなります。


酸性の二酸化炭素(CO₂)にはH⁺がないの?
いい疑問ですね!
二酸化炭素を水に溶かした時のイオンの変化を式に表すとこうなりそうですよね。


イオンの種類を知っていればわかるんだ!
そうです!丸暗記するんじゃなくて、イオンを覚えておけば発生するイオンを推理することができます!
それぞれのイオンの+の数、-の数は覚えておこう!
酸性の液体とアルカリ性の液体を混ぜると中和する
酸性を示すH⁺とアルカリ性を示すOH⁻が反応してH₂Oができる
中和によって「水」と「塩(えん)」ができる
今回のまとめクイズ!

次の学習も一緒に頑張ろうね!
次の学習
.jpg)


 サムネ-300x164.jpg)





コメント