中和滴定のイオンを考えよう!
塩酸と水酸化ナトリウムを混ぜると何ができる?

水と塩!
大正解!酸性の液体とアルカリ性の液体を混ぜて中和させると発生するんでしたね。
前回の学習では、イオンのモデル図で水ができる仕組みと水を蒸発させた時に塩(えん)ができる理由を考えました。
今回はそれをさらに詳しく考えて「イオン数の変化」まで考えられるようにレベルアップしていきましょう!
中和でイオン数はどう変わる?
ここでよくあるイオン数の問題に挑戦してみましょう!
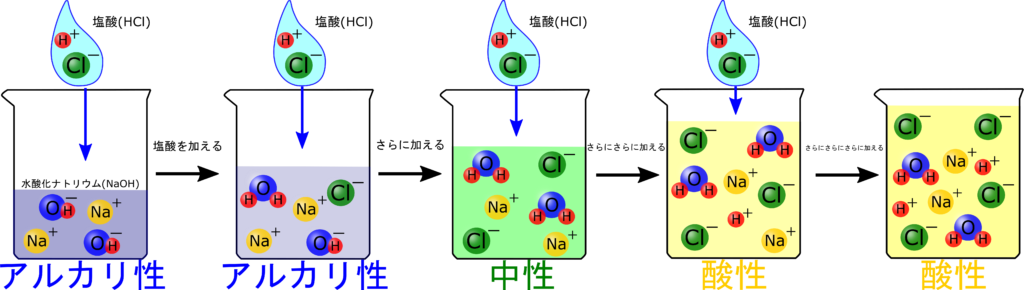
水酸化ナトリウム10mLに同じ濃度の塩酸20mLを加えていった時のH⁺の変化を表しているグラフは次のうちどれか?


情報がたくさんあってよくわからん!
まずは、情報を整理しよう!
最初に水酸化ナトリウムが入ったビーカーの中に存在するイオンがどのようになっているかをイラストで表すとこうなりますね。

イオンの数をイラストに表そう!
H⁺は何個あるでしょうか?

1個もない!
そうですね!っていうことは、グラフのスタート地点は0個のココになりますね。

こんな風にビーカーに入っているイオンの数をグラフ上にとっていけば、イオン数の問題を解くことができます!
次に塩酸を少し入れた時のイオン数を考えましょう。
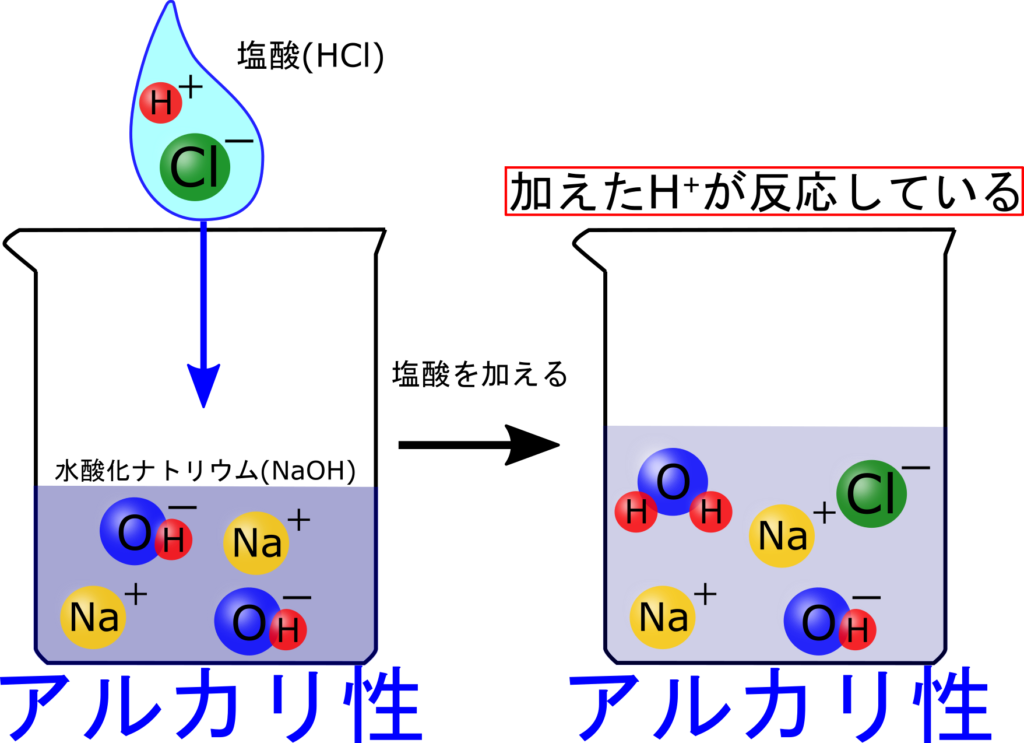
塩酸を少し入れると、H⁺が増えると思いましたが、増えませんでしたね。一体なぜでしょう?

H⁺が反応しちゃった?
大正解!H⁺とOH⁻が反応してH₂Oができるんだったね。
ということで、アルカリ性の水溶液にはOH⁻が存在しているから、H⁺はすぐに反応してH₂Oになってしまいます。


水溶液がアルカリ性の間はH⁺は増えないんだね♪
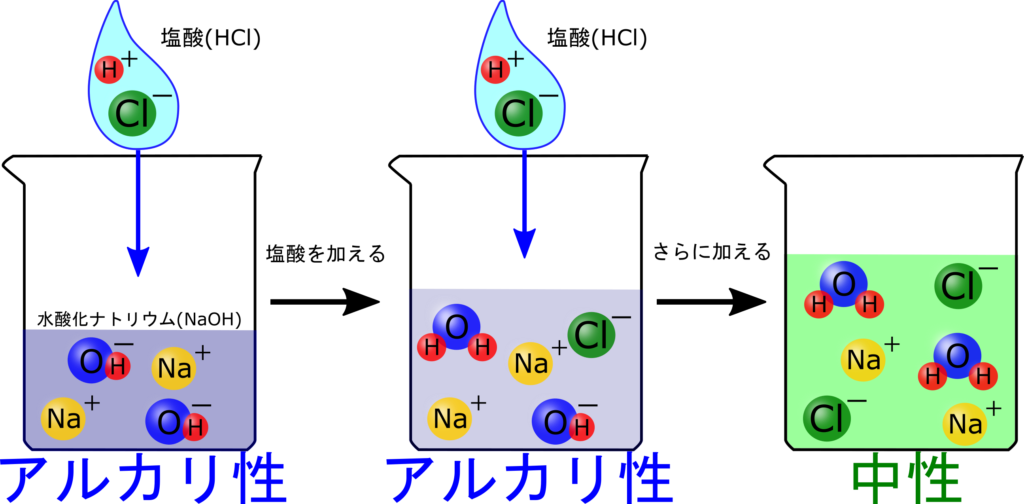
中性になるまで、塩酸を加えてみましょう。さて、塩酸を何mL入れれば中性になるでしょうか?

水酸化ナトリウムと塩酸は同じ濃度だったね。
そうですね。ってことは10mLの水酸化ナトリウムとピッタリ中和するためには、塩酸が10ml必要ですね。
つまり、塩酸を10mL加えた時に中性になる=OH⁻もH⁺なくなるわけです!
この時のビーカー内のイオンはこうなってます。
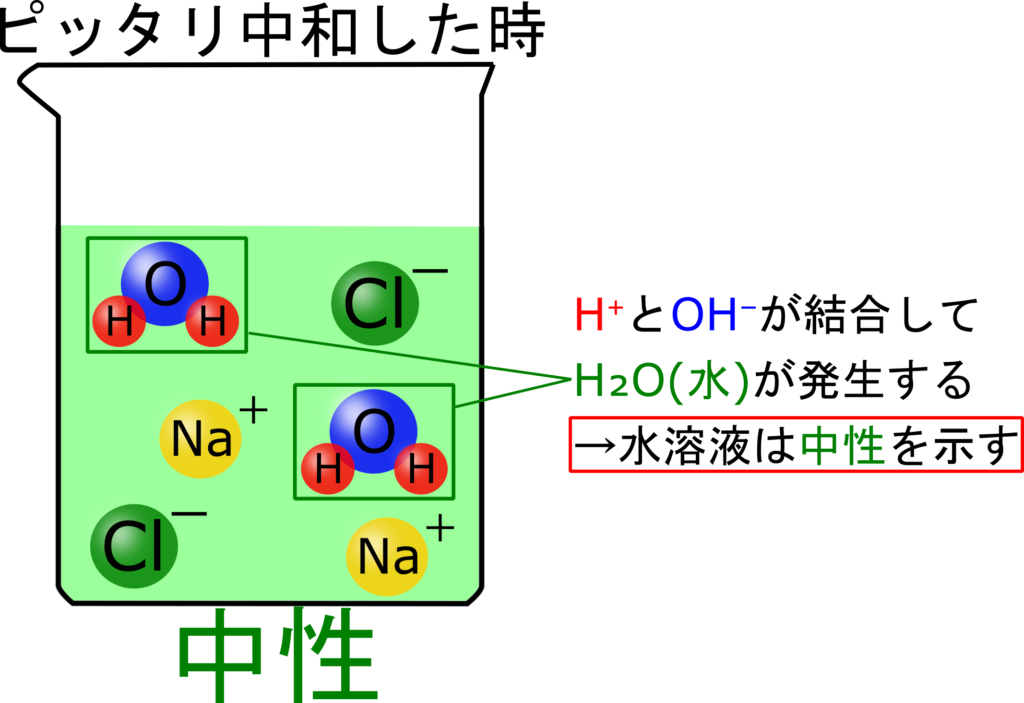

Na⁺とCl⁻だけあるね。
H⁺とOH⁻はピッタリ反応して全部H₂Oなってるからね。
加えたH⁺は反応してなくなる
中性になるまではH⁺が増えないから、H⁺の数をグラフで表すとこのようになります。


この後は増えるのかな?
はい、今ビーカーの中にはOH⁻が存在していないから、H⁺を入れても反応せず、ここからグラフは右肩上がりになります!
中性なっている水溶液に塩酸を加えていくと、
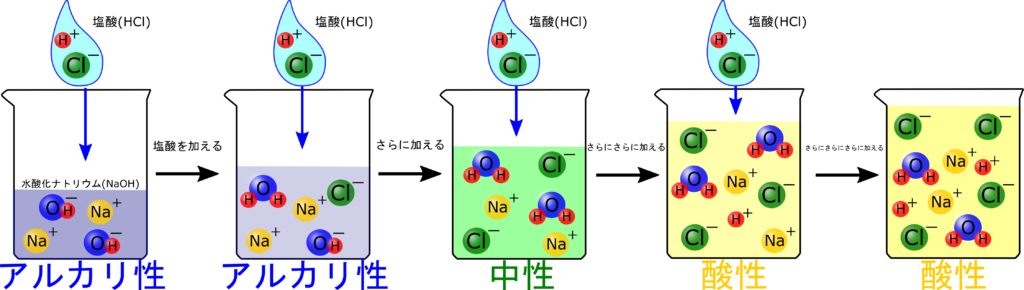

H⁺がそのままあるね!
さらに加えると加えた分だけH⁺はたまっていくから、グラフにすると右肩上がりになっていますね。


H⁺の数はこうなるんだね!
同じように考えて、ほかのイオン数の変化も理解しちゃいましょう!
OH⁻のグラフ
OH⁻のグラフを考えたい時も、H⁺みたいにビーカーの中にあるイオンのモデルを書けば一発でわかるよ!
ビーカーの中のイオンはこうやって変化していくんだったね。

このイラストのOH⁻に注目しよう!

最初はOH⁻がたくさんあって、だんだん減っているね。
それをグラフにするとこう!


だんだん減って中性になるとなくなっているね
酸性を示すH⁺とアルカリ性を示すOH⁻のグラフを合わせてみるとわかりやすいです。

OH⁻が存在している時はアルカリ性、H⁺が存在している時は酸性、どっちもない時は中性ってことがわかると理解が楽ちんですね。
塩酸を加えるごとに、
OH⁻が減る(アルカリ性)→OH⁻もH⁺もなくなる(中性)→H⁺が増える(酸性)
という変化がわかりますね!
ちょうど中性になるとH⁺とOH⁻がどちらも存在しなくなる
Na⁺のグラフ
Na⁺のイオン数もグラフを考えてみましょう!

さっきのイラストで考えればいいね♪
Na⁺はどのように変化していますか?

ずっと2個のまま!
だね。Na⁺はこの実験では、ほかのイオンと反応しない&増えていくことがないからずっと一定になります。
ってことでグラフはこう。


Na⁺は簡単だ~
Cl⁻のグラフ
最後にCl⁻のグラフも考えよう!

とにかくビーカーの図だね♪

Cl⁻も今回の実験では全く反応しないのはNa⁺と一緒だけど、Cl⁻は塩酸の中に含まれているから、塩酸を加えるにつれてCl⁻が増えていきますね。
なのでグラフはこう!

数学の一次関数みたいだね
加えた塩酸に比例して、Cl⁻も増えるからそうなるんだね!
中和滴定した時のイオン数はイラストを書いて考える!
沈殿ができるからどうかでもイオンの数は変わる
.jpg)




 サムネ-300x164.jpg)





コメント
コメント一覧 (5件)
まとめクイズについて。
水酸化ナトリウムに塩酸入れるのだから、H+のグラフは、上の方のOH-のグラフみたいな形になるのでは。
すみません、訂正
誤・水酸化ナトリウムに塩酸入れるのだから
正・塩酸に水酸化ナトリウム入れるのだから
まとめクイズの答えってグラフの右にいくにつれてアルカリになってくから右肩上がりなんじゃないの!?私そうやって解釈したから余計わかんなくなちゃったよ~~誰か教えてください…泣
問題文とグラフの文字が間違っていました!
水酸化ナトリウムを滴下ではなく塩酸を滴下する問題に訂正しました!
むみぽさん、てぇっさんありがとうございます!
いつも楽しく勉強させていただいています。
まとめクイズの件、
お忙しい中対応していただいてありがたいのですが、
水ナト水に塩酸を加えるので、
ア ̄ ̄ はNa+
イ_/ はH+
ウ/ はCl-
エ ̄\ は(正解となっているが)そもそも無くて、
問題文のOH-なら \_ が正しいかと。
グラフの作り替えは手間がかかるでしょうから、
いっそのこと問題文の「OH⁻の数を表したグラフはア~エのうちどれ?」を「H+の数」とし、正解のポップアップを「イ」とするのはどうでしょうか。
(とにかく正解のポップアップで エ は無理があるかと思います)。