鉄と硫黄を加熱すると硫化鉄が発生する
硫化鉄の性質を磁石・塩酸で調べる


温泉だ!!
はい、今回のテーマは温泉の化学です!
みなさんも温泉に来たつもりで温泉街をイメージしてください!

温泉のにおいがする~
ね、温泉地って独特のにおいがするよね。
この匂いは硫化水素(りゅうかすいそ)という気体のにおいなんです。

硫化水素?
そうです!今回は特有のにおいを持つ“硫化水素”をつくっていこうと思います!
温泉地ってどんな場所に多いか知ってますか?

山奥??
惜しいですね。温泉地が多いのは火山活動が多い場所とされています。温泉地のにおいは火山(マグマ)の活動と“硫黄(いおう)”が原因となっています。

硫黄?
はい、温泉地ってなんとなく「黄色」のイメージがありませんか?

確かに川とかが黄色くなってる!

その黄色の原因は硫黄なんです!硫黄はこんな物質です。

黄色い!
ですね!でもこの硫黄自体にはにおいはありません。

でも温泉地は変なにおいがするんだ?
不思議ですね!今回は硫黄を使って温泉地特有の“硫化水素”を発生させて温泉地の謎を調べていきましょう!

楽しみ♪
硫黄の実験
さっそく実験をしていきましょう!
今回使う物質は「硫黄」と「鉄」です。この2つを混ぜて加熱します。

それでは、実験の操作を確認していきましょう。
実験操作
①鉄(0.8g)と硫黄(1.4g)を乳鉢を使ってよく混ぜ合わせる
乳鉢を使ってよく混ぜ合わせると反応が早く進むから混ぜています。ただ、この実験はかなりよく反応するからそこまでまぜなくてOK!

混ぜた後は2つの試験管に混合物を分けます。(1/4と3/4)


なんでわけるの?
加熱した後に加熱前後の物質の違いを比べるためにキープしているんです。

比較用ってことね
そういうこと!
②混合物を加熱する
混合物を3/4取った試験管ににおいが漏れないように脱脂綿で口を閉じて加熱します。

加熱を始めると少し加熱部分が黒くなってきましたね。

この時、試験管の上部を加熱して、一部の色が変わったらガスバーナーの火を止めます。

途中で反応を止めるってこと??
いいえ!火は止めますが、この実験では、化学反応がはじまってから火を止めても反応が続くんです!

なんで??
不思議ですよね。その理由は後の結果のところで、実際の実験ムービーを見ながら考えていきましょう!
これが合図です!


反応がはじまったらガスバーナーの火を止める!
③加熱前後の物質を調べる
化学反応で物質がどう変化したか、塩酸&磁石で調べてみます。
さて、実験操作が頭に入ったら実験のムービーをみてみましょう!
結果
鉄と硫黄を反応させたムービーです!中学校で行う実験の中でも1,2を争うレベルで派手な実験です!

赤く燃えあがった!!
このムービの一番の見どころはそこですね!
鉄と硫黄を加熱すると、化学反応によってものすごい熱を発生させます!その熱がまるでマグマのように見えるんですね!

このように化学反応によって発生する熱を“反応熱”といいます。

本物のマグマなの?
実際のマグマも土の中にある鉄と硫黄があるきっかけで反応しているから、この試験管の中の反応も小さなマグマと言えます!かっこいいね!
鉄と硫黄の反応は大きな反応熱を出す

なんでガスバーナーを止めたの?
鉄と硫黄が化合する反応は、熱によって引き起こされますが、この実験は大きな反応熱が発生するからその反応熱によって反応が進むんです!

んん?どういうこと?
つまり
鉄と硫黄が反応する → 反応熱が出る → 熱で反応が進む → 反応熱が出る →・・・
っていうことです。

ループしてる!
そういうことです!熱が発生することによって反応のループが起こっているんですね!
反応がはじまれば勝手に進むから、ガスバーナーの役割は最初にきっかけをつくることになります。

ガスバーナーがスタートの合図!
ムービーを見ても、試験管の上部から反応がだんだん下にいっているのが分かると思います。
この時の化学反応を式にするとこのようになっています。


シンプルだね!
そうですね!1つの鉄原子(Fe)と1つの硫黄原子(S)がくっついて“硫化鉄(FeS)”ができるっていうわかりやすさ!!素晴らしい!
硫化鉄ができる時のように、硫黄がくっつく反応を“硫化(りゅうか)”といいます。

酸素がくっつくと酸化的な
そうです!酸素がつけば酸化、塩素がつけば塩化、硫黄がつけば硫化!めっちゃわかりやすいね!また、硫化によって出来た物質は“硫化物”といいます。これも酸化物と同じ感じです。
硫黄が化合することを硫化という
次に加熱前の混合物と加熱後と硫化鉄について詳しく調べてみましょう!
硫化鉄の性質
次の3つの要素について調べてみましょう!
①色&におい
②磁石を近づける
③塩酸を加える

塩酸が楽しそう♪
①色&におい
加熱前後の物質の色を比較してみましょう。
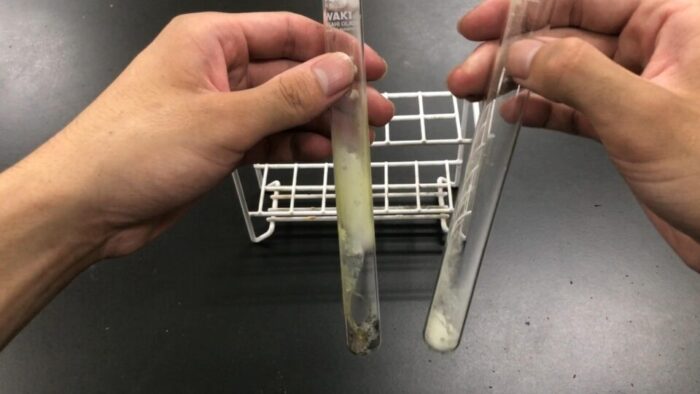

黒と白って感じだね
加熱した分、色が変化していますね。
じゃあにおいはどうでしょうか?

硫化鉄はすこしにおう、、
加熱前の混合物はほとんどにおいはないけど、加熱後は少しだけにおいがあるように感じますが、実際に純粋な硫化鉄ににおいはありません。実験に使う試料はどうしても混じり物があるから理科室で行う実験では、加熱後はにおいがあるように感じてしまいます。

ホントはにおいはないんだね!
そう覚えてください(笑)
②磁石を近づける
次に磁石を近づけてみましょう!
加熱前の物質に磁石を近づけると、物質が結構動きました!


面白っ!
さて、なんで加熱前の物質は磁石についたでしょうか?

鉄が入っているから!
その通り!加熱前は鉄と硫黄の混合物だから鉄が磁石に引き寄せられて、混合物が動きました。

硫黄はくっつかないの?
そうですね。硫黄は磁石につきません。
次に加熱後の硫化鉄を試してみると、まったく反応しませんでした。


鉄じゃなくなってるね
そうです、硫化鉄は反応前の鉄が持っていた磁石につく性質を失っているんです!
ピッタリ反応する質量比についてはコチラで詳しく解説しているので興味があれば読んでみてください♪
③塩酸を加える
続いて加熱前と後のどっちにも塩酸を加えてみましょう。
まず加熱前の鉄と硫黄の混合物ですが、鉄と塩酸の化学変化は1年生で学びましたね。何が発生するか覚えていますか?

水素!
その通り!塩酸に金属を入れると水素が発生するんでしたね!ちなみに水素は水上置換法で集めて、火のついたマッチを入れて小さな爆発が起こるかで確かめることができました。
忘れちゃった人はコチラで復習してください。(準備中)
というわけで、加熱前の物質に塩酸を入れると水素が発生します。

じゃあ、硫化鉄の場合はどうでしょうか?


気体が発生してる!
ですね!硫化鉄の場合も泡がでているので気体が発生していることがわかりますが、この気体は水素ではありません。
この気体こそが温泉地の特有のにおいの正体“硫化水素”です!
硫化水素は刺激臭を持つ気体で、実際に嗅いで欲しい気体です!
この時の化学反応式を書くとこのようになっています。
FeS + 2HCl → FeCl₂ + H₂S

結構単純だね
そうですね。硫化水素(HS)の名前からも水素(H)に硫黄(S)がくっついて硫化と同じことが起きていると考えることもできますね。
今回の硫化鉄を発生させた結果をまとめるとこのようになっています。

個人的にもアンモニアの噴水実験と1,2を争う面白実験だからぜひムービーを見てくださいね♪
鉄と硫黄を加熱すると大きな反応熱を出しながら硫化鉄(FeS)が発生する
硫黄が化合することを硫化という
硫化鉄に塩酸を加えると刺激臭をもつ硫化水素(HS)が発生する
今回のまとめクイズ!

お疲れ様!!
次の学習も一緒に頑張ろうね!
次の学習
次は中2の理科で一番大切な「化学反応式の書き方」を学ぶよ!絶対読んでね♪
.jpg)





 サムネ-300x164.jpg)



コメント
コメント一覧 (1件)
ためになりました。